合作客戶/
拜耳公司 |
同濟大學 |
聯(lián)合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關(guān)新聞Info
-
> 基于陰離子?非離子型表面活性劑復配最佳強化潤濕高效驅(qū)油體系——實驗部分
> 芬蘭Kibron表面張力測試儀跟蹤氯乙烯懸浮聚合中的表面張力變化情況
> 湍流飛濺與表面張力兩者之間有何關(guān)系?
> 軟包裝凹印常見問題的分析及對策
> 新型助排劑配方組分、對表/界面性能的影響及助排效果(一)
> pH對馬來松香MPA與納米Al2O3顆粒形成的Pickering乳液類型、表/界面張力影響(一)
> 液體表面張力對農(nóng)藥效果的影響及關(guān)鍵作用
> SuperG超微量天平工作原理、特點、參數(shù)、操作方法
> 七葉皂素分子在氣-液、液-液(油-水)、固-液界面上的界面行為研究(三)
> 兩種烷基咪唑亞磷酸酯離子液體熱穩(wěn)定性、表面張力測定(一)
推薦新聞Info
-
> 海上抗超高溫低滲透儲層鉆開液配方設(shè)計及應(yīng)用效果(三)
> 海上抗超高溫低滲透儲層鉆開液配方設(shè)計及應(yīng)用效果(二)
> 海上抗超高溫低滲透儲層鉆開液配方設(shè)計及應(yīng)用效果(一)
> 表面張力儀和界面張力儀通用可能性及選擇要點
> 表面張力儀和界面張力儀是通用的嗎?
> 從潤濕到粘附:臨界表面張力(γc)如何重塑表界面科學?
> 添加表面活性劑抑制瓦斯解吸效果及機理分析
> 常見表面活性劑分類、性質(zhì)、水溶液潤濕性、與表面張力間的關(guān)系
> ?基于LB膜技術(shù)的仿生膠原膜模塊化組裝方法
> 明確巖心孔喉大小及分布,構(gòu)建低滲透油藏CO2驅(qū)開發(fā)全過程動態(tài)預(yù)測模型(二)
酯化度與分子質(zhì)量對果膠乳化性能、聚集體結(jié)構(gòu)、界面性質(zhì)的影響規(guī)律(二)
來源:食品科學 瀏覽 66 次 發(fā)布時間:2025-10-10
1.3.4果膠聚集體尺寸測定
將不同分子質(zhì)量和酯化度的果膠儲備液稀釋至1 mg/mL(高于臨界聚集質(zhì)量濃度),在4℃條件下穩(wěn)定過夜。采用納米粒度電位儀測定果膠聚集體的流體力學直徑。檢測溫度保持在25℃,散射角設(shè)置為173°。
1.3.5界面張力測試
采用Kibron界面張力儀檢測不同果膠樣品在油-水界面吸附過程中的動態(tài)界面張力。測試時,首先對儀器進行預(yù)熱與校準,并確保所使用的鉑金du Nouy環(huán)或Wilhelmy板經(jīng)過徹底清潔。隨后,將約15毫升的玉米油注入潔凈的專用玻璃樣品皿中,并將其平穩(wěn)置于儀器樣品臺上。通過軟件控制,使鉑金探針精確定位于油-空氣界面以建立穩(wěn)定的初始基線。
完成準備工作后,使用移液器將一定體積(如1.0毫升)的果膠溶液(濃度為10毫克/毫升)沿樣品皿壁緩慢注入油相底部,由于密度差異,果膠溶液會在下層形成一個清晰的、平坦的油-水界面。立即在儀器軟件中啟動動態(tài)時間測量模式,系統(tǒng)將開始自動、連續(xù)地記錄界面張力隨時間的變化。該測量過程持續(xù)進行40分鐘,軟件會以設(shè)定的高頻率(如每秒一次)采集并存儲數(shù)據(jù)。整個實驗過程中,界面張力的變化反映了果膠分子從水相體相擴散至油-水界面并發(fā)生吸附、重排的動態(tài)過程。
1.3.6乳液制備
將不同果膠溶解于去離子水中,并在室溫下攪拌過夜,配制成質(zhì)量濃度為10 mg/mL的果膠溶液。取5 mL玉米油與95 mL果膠溶液混合,使用高速剪切機以10 000 r/min的轉(zhuǎn)速剪切3 min,制備粗乳液。隨后,將粗乳液通過高壓均質(zhì)機在60 MPa壓力下均質(zhì)3次,得到果膠乳液。
1.3.7乳液粒徑表征
采用納米粒度電位儀測試不同果膠乳液的平均粒徑。為避免多重散射效應(yīng)的影響,將果膠乳液用去離子水稀釋500倍后,取1 mL稀釋液進行粒徑檢測。測試條件:溫度25℃、散射角173°。
1.3.8乳液穩(wěn)定性測定
將新鮮制備的果膠乳液于4℃條件下貯藏。貯藏7 d后對乳液的粒徑進行表征,根據(jù)粒徑變化評估乳液的穩(wěn)定性。
1.3.9單位面積界面吸附量測定
參考Yang Yaqin等的方法并略作修改。根據(jù)乳液離心后未在界面吸附的果膠量,計算果膠在界面的單位面積吸附量。由于乳液樣品黏度較大,為確保界面吸附果膠與水相果膠的徹底分離,將新鮮制備的乳液先用去離子水稀釋100倍后,再在10 000 r/min的轉(zhuǎn)速下離心30 min。下層清液中的果膠質(zhì)量濃度測定參考Ma Xuemei等的方法并略作修改。取離心后的下層清液3 mL,加入0.6 mL咔唑-乙醇溶液、6 mL濃硫酸,混勻后置于沸水浴中加熱10 min,冷卻至室溫,置于暗處靜置30 min,使用酶標儀在530 nm波長處測定吸光度,根據(jù)標準曲線方程計算下層清液中果膠的濃度。果膠在乳滴界面的單位面積吸附量按式(2)計算:
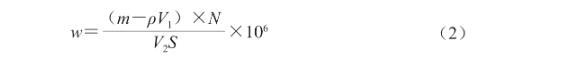
式中:w為單位面積界面吸附量/(ng/cm2);m為果膠質(zhì)量/mg;ρ為下層清液中果膠質(zhì)量濃度/(mg/mL);V1為下層清液體積/mL;V2為乳液體積/mL;N為稀釋倍數(shù);S為每毫升乳液中乳滴的總表面積/cm2,可由油相體積與乳滴粒徑計算獲得。
1.3.10界面吸附層厚度測定
參考Siew等的方法并略作修改。利用前期制得的聚苯乙烯微球(平均粒徑167 nm),將不同結(jié)構(gòu)的果膠溶液(10 mg/mL)與聚苯乙烯微球分散液等體積混合,攪拌過夜。用納米粒度電位儀測定微球的粒徑,根據(jù)果膠吸附前后微球的粒徑變化,分析果膠在界面的吸附層厚度。
1.4數(shù)據(jù)處理
所有實驗均進行3次平行,結(jié)果表示為。運用SPSS 20軟件進行顯著性分析(P<0.05表示差異顯著),使用OriginPro 2024軟件作圖。
2結(jié)果與分析
2.1不同果膠的酯化度、分子質(zhì)量分析
為探究酯化度、分子質(zhì)量對果膠乳化性能的影響及其機制,本研究采用堿脫酯、酸水解法制備不同酯化度與分子質(zhì)量的果膠。圖1顯示,脫酯時間為0、10、20、30 min時所獲得的果膠酯化度分別為73%、65%、51%、35%;水解時間為0、1、2、4 h時所獲得的果膠分子質(zhì)量分別為1.30×105、0.84×105、0.72×105 Da和0.55×105 Da。由于官能團(如甲基、羧基)與分子結(jié)構(gòu)等的差異,不同果膠在溶液中可表現(xiàn)出不同的分子間作用力(如疏水相互作用、靜電斥力),進而形成不同結(jié)構(gòu)的聚集體,可能對其乳化性能造成顯著影響。
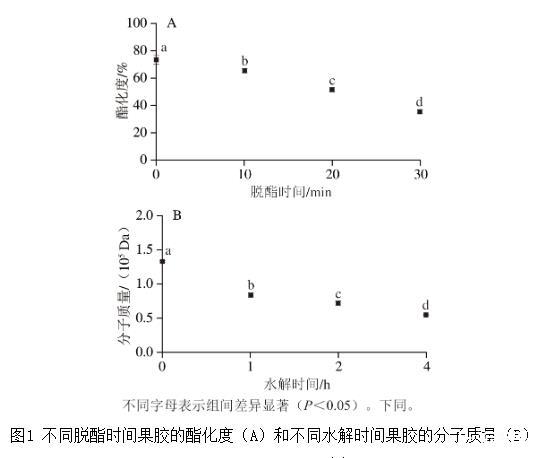
圖1不同脫酯時間果膠的酯化度(A)和不同水解時間果膠的分子質(zhì)量(B)
2.2酯化度對果膠聚集行為和聚集體結(jié)構(gòu)的影響
本研究采用熒光探針法,通過測定芘在果膠溶液中I373 nm/I383 nm隨果膠質(zhì)量濃度的變化,分析不同酯化度果膠在溶液中的聚集行為。如圖2A所示,在低質(zhì)量濃度果膠溶液(0.005~0.100 mg/mL)中,芘的I373 nm/I383 nm(1.41~1.43)與芘在水溶液中的I373 nm/I383 nm(1.44)接近,且基本保持不變,表明果膠分子以單分子形式良好分散,未形成疏水結(jié)構(gòu)。當果膠質(zhì)量濃度超過0.100 mg/mL后,I373 nm/I383 nm隨果膠質(zhì)量濃度增加顯著下降,意味著果膠分子組裝形成了具有內(nèi)部疏水微區(qū)的果膠聚集體。
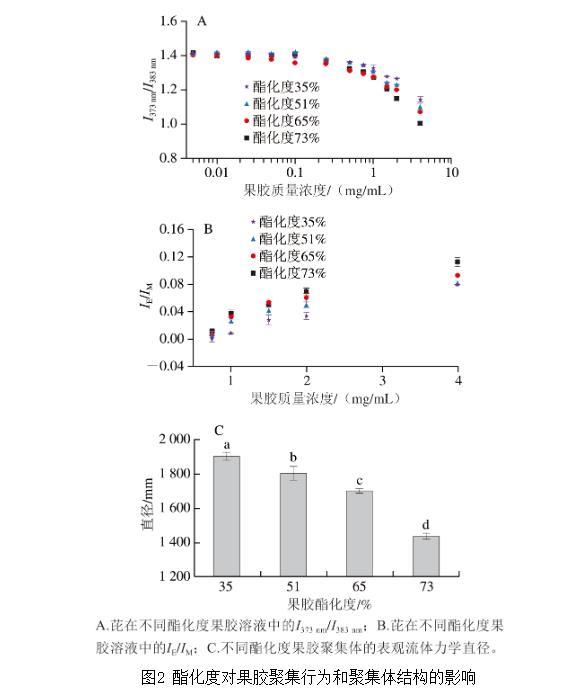
圖2酯化度對果膠聚集行為和聚集體結(jié)構(gòu)的影響
酯化度為35%、51%、65%、73%的果膠臨界聚集質(zhì)量濃度分別為0.87、0.56、0.50 mg/mL和0.36 mg/mL;此外,在高于果膠臨界聚集濃度的條件下,芘在不同酯化度果膠溶液中的I373 nm/I383 nm展現(xiàn)出顯著差異,依次為酯化度35%組>酯化度51%組>酯化度65%組>酯化度73%組。這些結(jié)果表明,酯化度高的果膠更易聚集,具有更低的臨界聚集濃度,且形成的聚集體內(nèi)部疏水性更強。這一現(xiàn)象可歸因于高酯化度果膠分子鏈上具有更多的甲基和更少的羧基,導致分子間疏水作用力增強,靜電作用力減弱,從而促進了果膠分子在溶液中的聚集,并形成內(nèi)部更加疏水的聚集體。
如圖2B所示,芘在高酯化度果膠溶液中表現(xiàn)出更高的IE/IM。這可能是因為高酯化度果膠形成的聚集體內(nèi)部具有更多且極性更低的疏水微區(qū),促進了芘分子在疏水微區(qū)中的溶解和分布,進而增加了芘二聚體的形成,最終導致IE/IM升高。這一結(jié)果進一步驗證了高酯化度果膠形成的聚集體更疏水的結(jié)論。
采用動態(tài)光散射分析了不同酯化度果膠在相同質(zhì)量濃度(2 mg/mL)下形成的聚集體尺寸。如圖2C所示,隨著果膠酯化度的增加,聚集體尺寸呈現(xiàn)規(guī)律性減小的趨勢,其直徑分別為1 950(酯化度35%)、1 805(酯化度51%)、1 690 nm(酯化度65%)和1 443 nm(酯化度73%)。聚集體尺寸隨果膠酯化度呈現(xiàn)規(guī)律性變化與果膠分子間靜電斥力有關(guān)。隨著酯化度的增加,果膠分子鏈上的羧基含量降低,導致分子間的靜電斥力減弱,使得聚集體內(nèi)果膠分子的排布更為緊湊,最終導致聚集體尺寸減小。結(jié)合熒光探針法的結(jié)果,可以得出結(jié)論:酯化度更高的果膠更易發(fā)生聚集,形成尺寸更小、結(jié)構(gòu)更緊湊的聚集體,且其聚集體內(nèi)部的疏水微區(qū)體積更大、極性更低。
2.3分子質(zhì)量對果膠聚集行為和聚集體結(jié)構(gòu)的影響
為研究分子質(zhì)量對果膠聚集行為的影響,本實驗分析了芘在不同分子質(zhì)量果膠溶液中的I373 nm/I383 nm。如圖3A所示,在4種不同分子質(zhì)量的果膠溶液中,芘的I373 nm/I383 nm均在果膠質(zhì)量濃度達到特定值后開始降低,表明這些果膠均可在溶液中組裝形成包含疏水微區(qū)的聚集體。分子質(zhì)量為0.55×105、0.72×105、0.84×105 Da和1.30×105 Da果膠的臨界聚集質(zhì)量濃度分別為0.52、0.50、0.45 mg/mL和0.36 mg/mL。此外,在高于臨界聚集濃度的條件下,高分子質(zhì)量果膠呈現(xiàn)出更低的I373 nm/I383 nm。這些結(jié)果表明高分子質(zhì)量果膠更易發(fā)生聚集,且形成的聚集體內(nèi)部疏水微區(qū)的極性更低。
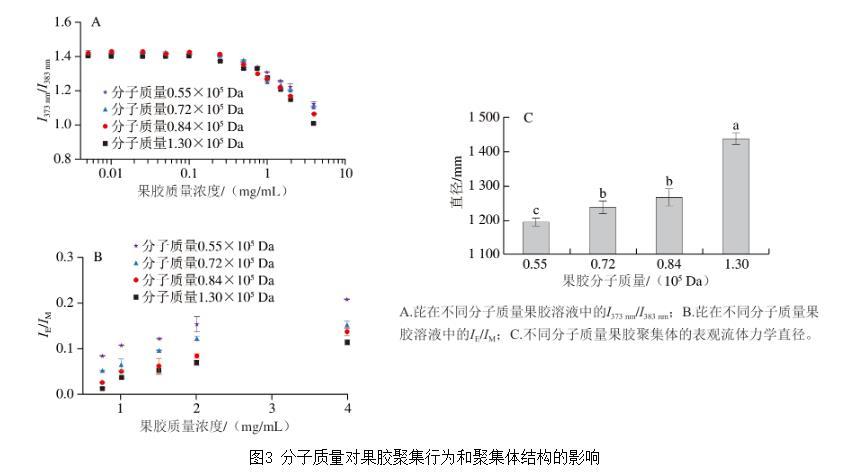
圖3分子質(zhì)量對果膠聚集行為和聚集體結(jié)構(gòu)的影響
果膠分子主鏈可簡化視為由富含甲酯基的疏水鏈段以及富含羧基的親水鏈段構(gòu)成。當果膠質(zhì)量濃度超過臨界聚集濃度后,不同果膠分子的疏水鏈段因距離接近而產(chǎn)生疏水相互作用,進而發(fā)生聚集,形成果膠聚集體。在本研究中,較低分子質(zhì)量的果膠是通過水解最大分子質(zhì)量的果膠得到。水解過程可能導致疏水鏈段斷裂,因此低分子質(zhì)量果膠在溶液中表現(xiàn)出更弱的聚集行為,且形成的聚集體內(nèi)部疏水微區(qū)呈現(xiàn)出較高的極性。
如圖3B所示,在任意高于臨界聚集濃度的條件下,芘的IE/IM隨果膠分子質(zhì)量的增加呈現(xiàn)規(guī)律性降低。這與果膠形成聚集體內(nèi)的疏水微區(qū)結(jié)構(gòu)有關(guān)。雖然高分子質(zhì)量果膠形成的聚集體具有極性更低、對芘溶解度更高的疏水微區(qū),但由于疏水微區(qū)尺寸較大,降低了芘分子間的接觸概率,從而減少了芘二聚體的生成,最終表現(xiàn)為較低的IE/IM。
圖3C展示了不同分子質(zhì)量果膠在同一質(zhì)量濃度(2 mg/mL)下所形成的聚集體的尺寸。果膠聚集體的尺寸隨分子質(zhì)量的增加而顯著增大。具體而言,分子質(zhì)量為0.55×105 Da果膠形成的聚集體直徑約為1 195 nm,而分子質(zhì)量為1.30×105 Da果膠形成的聚集體直徑則增加至1 443 nm。綜上所述,高分子質(zhì)量的果膠更容易發(fā)生聚集,形成的聚集體尺寸更大,且內(nèi)部的疏水微區(qū)體積更大、極性更低。










